Холестерин и реальность
Что надо знать о холестерине.
Повышенные уровни холестерина в плазме крови играют центральную роль в развитии атеросклероза. Большая часть холестерина, циркулирующего в плазме, транспортируется как составная часть липопротеинов низкой плотности (ЛПНП) или ЛПВП. Риск заболевания коронарной артерии напрямую связан с уровнем ХС-ЛПНП в плазме и обратно связан с уровнями ХС-ЛПВП в плазме ( Kannel et al., 1979)).
Традиционно считается, что чем выше содержание ХС- ЛПВП в плазме, тем активнее проявляется защитная функция ЛПВП. И целью профилактики сердечно-сосудистых заболеваний (ССЗ) является повышение этого показателя.
Так, по данным Фрэмингемского исследования, низкие уровни ХС- ЛПВП являются достоверно более мощным липидным фактором риска, чем высокие уровни. По меньшей мере в пяти различных популяционных исследованиях была подтверждена тесная корреляция между ИБС и низкими уровнями ХС- ЛПВП, не зависимая от других факторов. Среди белых американцев средний уровень ЛПВП составляет 1,2 ммоль / л (45 мг / дл) у мужчин и 1,4 ммоль / л (55 мг / дл) у женщин [ 2 ].
В исследовании В.Я. Полонской и соавт. была выявлена корреляция между уровнем
лептина и повышенным уровнем ЛПНП, С-реактивного белка, степенью выраженности ожирения и снижением уровня ЛПВП у мужчин с коронароангиографически верифицированным атеросклерозом.
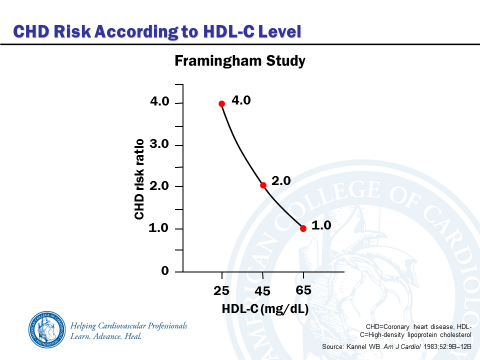
Согласуясь с данными о неодинаковом риске развития ИБС у представителей разного пола, показано, что уровни ХС ЛПВП у женщин в среднем на 25 % выше, чем у мужчин. Отмечена тенденция к повышению их уровней под влиянием эстрогенов и снижению под влиянием андрогенов. Низкие уровни ХС- ЛПВП у женщин наблюдаются при сахарном диабете и ожирении, что значительно повышает риск ИБС. У долгожителей уровни ЛП этого класса обычно высокие, что частично может носить семейный характер. В рекомендациях [3] по скринингу кардиваскулярных рисков уровень ХС ЛПВП признан сильным риск-фактором ( класс I уровень С). До начала лечения дислипидемии рекомендован анализ ХС ЛПВП ( класс I уровень С). Не требуется лечение с целью контроля ХС ЛПВП (Класс 3 уровень С).
Рис. Европейские рекомендации по ЛПВП 2016г. Рис. Влияние лекарств на уровень ЛПВП.


Ежедневный прием алкоголя в небольших количествах сочетается с пониженным риском развития ИБС и высокими уровнями ЛПВП. Механизмы этого неизвестны. У больных метаболическим синдромом, при медленном похудании, увеличивается в плазме ХС ЛПВП. А при быстром похудании, более 4 кг в месяц, этот показатель снижается ( Wirth A., 2006). При проведении профилактических мероприятий было установлено, что табакокурение сопровождается понижением уровней ХС ЛПВП , а регулярная физическая активность – их повышением. Регулярные физические тренировки приводят к росту уровней ХС- ЛПВП у лиц, перенесших инфаркт миокарда. Было доказано, что диета с низким содержанием жира и высоким процентом углеводов приводит к снижению уровня ХС- ЛПНП, ХС- ЛПВП, и ТГ. А снижение массы тела и повышение физической активности повышает концентрацию ХС- ЛПВП [ 9 ]. В исследовании Kaiser Permanente установлено, что каждое повышение уровня ХС ЛПВП на 5 мг/дл связано с 4%-м сокращением риска госпитализации по причине сердечных заболеваний или инсульта. А понижение уровня ХС ЛПВП на 6,5 мг/дл в свою очередь увеличивало риски госпитализации на 11%. о результатам исследования НАТS у 160 больных ИБС был подтвержден ангиографически стеноз коронарных артерий и низкий уровень ХС ЛПВП . Назначение витамина Е в сутки 800 мг, витамина С 25 мг, бетакаротина 100 мг, селена, симвастатина, ниацина проводилось 3 года. В группе симвастатин+ниацин установлено повышение ХС ЛПВП на 26%, низкая частота сердечно-сосудистых событий (ССС)- 3%. В группе антиоксидантов- 21% ССС, в группе симвастатин+ ниацин +антиоксиданты- 14% ССС.Назначение магния 20 ммоль (487mg) в сутки в течение 8 недель достоверно снизило уровень ОХС в плазме крови на 1,3 ммоль\л (Parki P.S.,1990). В исследовании ALPINE назначение больным АГ атенолола и гипотиазида снизило уровень ХС ЛПВП и повысило уровень ХС ЛПНП [10]. FISH –трайл показал, что у больных АГ монотерапия метопрололом приводила к значительному росту уровня ТГ и снижению уровня ЛПВП.В исследовании SLIP лечение больных АГ верапамилом 240 мг\сутки достоверно увеличило уровень ЛПВП. В трайле TOMHS при лечении больных АГ уровень ЛПВП снизился на 0,6+_0,7 мг\дл в группе ацебутолола 400 мг\сут. И повысился на 0,2+-0,7 мг\дл в группе амлодипина 5 мг\сут. А также на 0,6+-0,8 мг\дл в группе хлорталидона 15 мг\сут. В исследовании с использованием МРТ было обнаружено, что у носителей мутаций гена LCAT со сниженным уровнем ХС ЛПВП чаще диагностируется атеросклероз сонных артерий (Duivenvoorden et al, 2011 ). Также низкий уровень ЛПВП ассоциировался с показателем плохой выживаемости после операции аорто-коронарного шунтирования [ 2 ].
Уровень ЛПВП в крови был достоверно ниже у больных ИБС с наличием H. pylori (35,580±0,9485 мг/дл; p<0,001). После проведенной эрадикационной терапии у больных отмечено снижение уровня ЛПНП – на 29,1±1,6%, достоверное увеличение уровня ЛПВП – на 30±2,4% (Азизов В.А.).
11 лет наблюдения за женщинами в постменопаузе установили рост случаев рака при повышении уровня ХС ЛПНП и понижении ХС ЛПВП (tw/10.3390/jcm8060853).
Обзор ЛПВП.
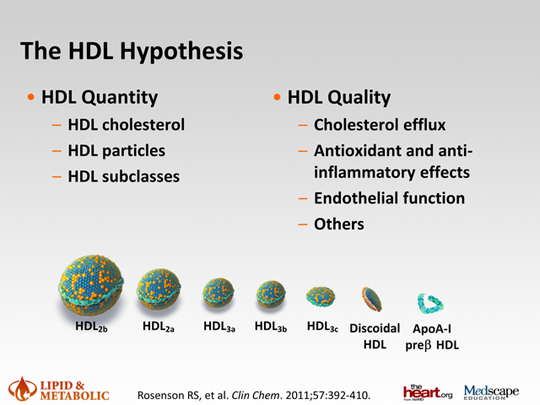
ЛПВП представляют собой сложную группу частиц, переносящих приблизительно 20 % всего холестерина плазмы [1 ] . В плазме преобладают сферические ЛПВП [6 ] . Они крупных размеров, от 8 до 12 нм. В гидрофобном ядре содержат эфиры ХС и триглицеридов (ТГ). По плотности частиц выделены два основных подкласса ЛПВП. ЛПВП2- это большие, легкие, богатые липидами частицы. ЛПВП3- частицы меньших размеров, плотные, богатые белком. Методом гель-электрофореза разделены субфракции ЛПВП, по убыванию размера это ЛПВП2b, ЛПВП2a, ЛПВП3a, ЛПВП3b, ЛПВП3c. Установлено преобладание свободного ХС над эфирами ХС, сфингомиелина над фосфатидилхолином для ЛПВП2в с уменьшением пропорции вправо к ЛПВП3с. Дисковидные ЛПВП имеют малые размеры, менее 7 нм. Содержат меньше липидов, менее 30%, и больше аполипопротеидов А1 (апоА1). Последние преобладают среди белков ЛПВП (70%). Подвижные амфипатические α -спирали апоА1 активно связывают липиды и выполняют основную функцию ЛПВП.
Применяя двумерный электрофорез, открыты подвиды ЛПВП- это пре β - частицы, содержащие апоА1 и фосфолипиды. Не известна конкретная функция каждого из 60 видов белка. ЛПВП осуществляют обратный транспорт ХС из периферических тканей, в том числе из стенок артерий, в печень. Бедные липидами и богатые апоА1 ,маленькие частицы ЛПВП вызывают редуцирование атеросклеротической бляшки, осуществляя отток ХС из макрофагов путем АВСА1(кассетный транспортный белок). Это обусловлено большей текучестью поверхностного слоя ЛП и конформацией апоА1.
АпоА1 является каркасным белком для частиц ЛПВП. ApoA-I зависит от белка-переносчика липидов, называемого ABCA1, который перекачивает холестерин и фосфолипиды от внутреннего к наружному листку клеточной мембраны.
Крупные ЛПВП, так как их больше числом, через ABCG1 транспортируют ХС и 7-кетостерины. А посредством скэвенджер-рецепторов класса В типа 1 (SR-B1) поглощают эфиры ХС. Без рецепторов проходит пассивная диффузия ХС по градиенту концентрации. Маленькие плотные ЛПВП3 защищают ЛПНП от перекисного окисления свободными радикалами. Альдегиды и окисленные ФЛ восстанавливаются путем окисления метиониновых остатков апоА1. Сферические ЛПВП в большей мере, чем дисковидные, ингибируют синтез провоспалительных цитокинов, адгезию моноцитов к эндотелию, экспрессию молекул адгезии на клетках эндотелия, активацию нейтрофилов и их инфильтрацию в стенки артерий. ЛПВП3 тормозят и аннулируют апоптоз клеток эндотелия, вызванного факторами роста. Стимулируют миграцию и выживание эндотелиальных клеток. Уменьшают выход в цитоплазму цитохрома С и фактора индукции апоптоза. ЛПВП2, ЛПВП3 через SR-B1 и сфингозин-1-фосфат запускают фосфорилирование эндотелиальной NO-синтетазы. Стимулируют синтез простациклинов (ПГI2). Такой механизм присущ для никотиновой кислоты и дальцетрапиба. ЛПВП2, имея апоЕ, ингибируют активацию тромбоцитов, тканевой фактор свертывания крови, Х,Vа,VIIIа фактор. При инфекции ЛПВП через апоА1 связывают и утилизируют циркулирующие липо- полисахариды. Плотные ЛПВП, диаметром 15-21 нм, через апоL1, апоА2, апоС1,апоС2, апоС3 вызывают лизис трипаносом. При атеросклерозе ЛПВП транспортируют избыток ХС из артериальной стенки в печень для удаления из организма. При патологических состояниях меняется белковый и липидный состав плазмы. Дислипидемии, нарушение резистентности к инсулину,системное воспаление, инфекции, острый коронарный синдром, менопауза вызывают снижение нормальной биологической активности ЛПВП. В структуре ЛПВП3 уменьшаются эфиры ХС, апоА1, параоксоназы1, лецитинхолестеринацил-трансферазы. Увеличивается уровень ТГ. Снижается антиоксидантная и противо-воспалительная активность ЛПВП.
Рис. .Подклассы ЛПВП и их функции.
Рис. Основные функции ЛПВP (антиоксидантная, антивоспалительная, антитромботическая, антиишемическая, антидиабетическая).
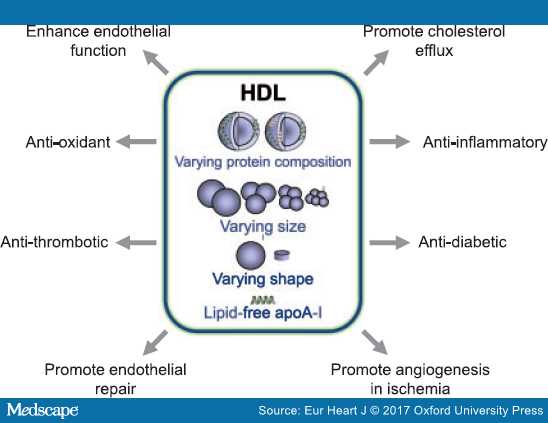
Сегодня установлено, что уровень ХС ЛПВП не зависит от функции оттока ХС из макрофагов, и не может быть сегодня маркером сердечно-сосудистых заболеваний ( ССЗ). У лиц с генетически детерминированным высоким уровнем ЛПВП не наблюдается снижения сердечно-сосудистых заболеваний ( Benjamin Voight, Philadelphia, online, May 16, 2012, Lancet) .
Индоазиаты имеют самые высокие показатели заболеваемости ИБС, несмотря на то, что почти половина из них на протяжении всей жизни придерживаются вегетарианства. У индоазиатов наблюдают уменьшение в плазме кардио-протекторных мелких частиц ЛПВП-3 и крупных ЛПВП-2, среди 90% популяции –обнаружен дефицит наиболее ценных ЛПВП-2b [17]. При построении функций 30-летней выживаемости среди мужчин 40-59 лет достоверная наибольшая выживаемость установлена при уровне ХС ЛПВП 1,7 ммоль\л, но не выше (Меньщиков А.А., 2013, РФ).
В большинстве японских эпидемиологических исследований [12] не установлена связь между инсультами и высоким уровнем общего ХС ( ОХС). Люди с чрезвычайно высоким уровнем холестерина ЛПВП имеют увеличенный, а не уменьшенный риск смерти от сердечно-сосудистых заболеваний, рака и других причин (Madsen et al . ). В метаанализе 19 когортных исследований [13] уровень общего ХС был обратно пропорционален смертности от респираторных и желудочно-кишечных заболеваний, большинство из которых имели инфекционное происхождение. В результате экспериментов на грызунах еще в 1996 году установлен рост случаев рака после снижения ОХС [14]. У лиц с семейной гиперхолестеринемией оказалась ниже смертность от рака [15].
Измерили профиль липидов[20] у больных NSTEMI в течение первых суток госпитализации. 264 пациента из 517 имели уровень ХС-ЛПНП менее 105 мг\дл. Через 3 года установлена смертность от всех причин в 2 раза выше в группе низкого ХС-ЛПНП (14,8% против 7,1%, р = 0,005).
Среди пациентов 541 больницы определили [21] уровень липидов у 136 905 больных, поступивших в первые 24 часа обострения ИБС. Половина больных имели: уровень ХС-ЛПНП менее 100 мг\дл , уровень ХС-ЛПВП менее 40 мг\дл.
Кроме того, многочисленные японские исследования [22] показали, что высокий уровень LDL-C не является фактором риска смертности от ИБС у женщин любого возраста. Имеющиеся данные из рандомизированных контролируемых исследований показывают, что замена насыщенного жира линолевой кислотой эффективно снижает уровень холестерина в сыворотке, но не подтверждает гипотезу, что это приводит к снижению риска смерти от ИБС или от всех причин. Результаты The Minnesota Coronary Experiment [11] дополняют растущие доказательства того, что неполная публикация данных способствовала переоценке выгод и недооценке потенциальных рисков, заменяя в питании насыщенные жиры растительными маслами, богатыми линолевой кислотой. Проблема в том, что сердечно-сосудистые события развиваются чаще в коронарных артериях в зонах стеноза менее 70% просвета, а также вне их. Диагностика и лечение этих больных затруднено скрытым течением атеросклероза и низким результатом стресс-тестов на ИБС.
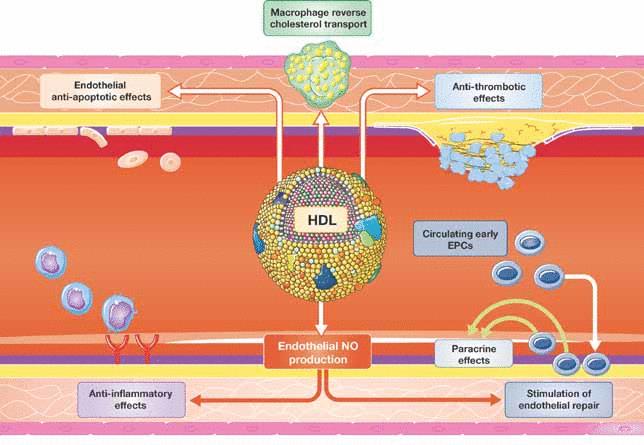
Рис.Помимо стимуляции переноса холестерина макрофагов, ЛПВП ингибируют воспалительную активацию эндотелия и способствует эндотелиальному восстановлению. Оба эффекта зависят от продуцирования NO эндотелия. Кроме того, HDL оказывают антиапоптотическое и антитромботическое действие.
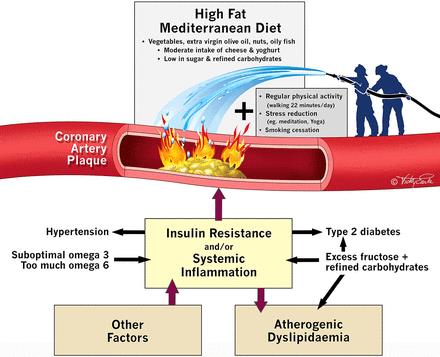
Рис.Лечение и профилактика коронарного атеросклероза (http://dx.doi.org/10.1136/bjsports-2016-097285
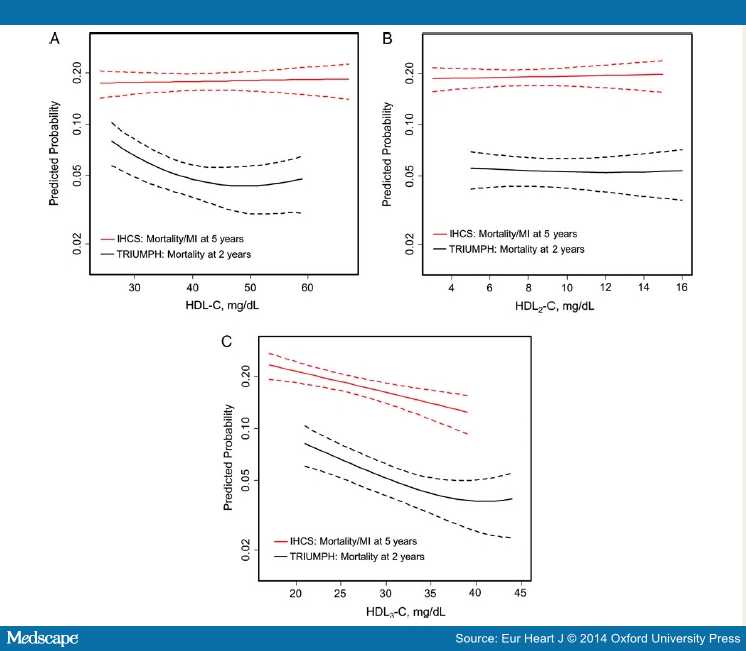
Исследования TRIUMPH и IHCS [5]. Изучалась связь подклассов ХС ЛПВП (HDL-C) прогнозом вторичной профилактики ИБС.Методы. Проанализированы данные двух когорт: TRIUMPH study обследовано 2465 больных острым инфарктом миокарда; IHCS study обследовано 2414 пациента методом коронарной ангиграфии. Всем пациентам определены базовые подклассы ХС ЛПВП ультрацентрифугированием. Стратифицировали тертили HDL-C и два подкласса (HDL2-C, HDL3-C). Пациенты были среднего возраста (TRIUMPH: 58.2 ± 12.2 лет; IHCS: 62.6 ± 12.6 лет). Большинство из них были мужчины (TRIUMPH: 68.0%; IHCS: 65.5%). В трайле IHCS были ниже значения HDL-C (34.6 ± 10.1 mg/dL) по сравнению с TRIUMPH (40 ± 10.6 mg/dL). Доля HDL3-C составила >3/4 от HDL-C (коэффициент HDL3-C/HDL-C равнялся 0.78 ± 0.05 в обоих когортах). Результаты. За 2 года наблюдения в исследовании TRIUMPH смертность составила 226 случаев (9.2%). За 5 лет наблюдения IHCS летальность от инфаркта миокарда констатирована среди 401 больных (16.6%) . Не установлено зависимости событий с уровнями HDL-C и HDL2-C. В отличие от этого, низкий тертиль HDL3-C достоверно ассоциировался в каждой когорте с высоким более 50% риском. В трайле TRIUMPH корреляция смертности с HDL3-C составляла HR 1.57; 95% CI, 1.13–2.18 ; в исследовании IHCS для показателя смертности от инфаркта миокарда : HR 1.55; 95% CI, 1.20–2.00).
Рис. Скорректированные сплайн-кривые параметров ЛПВП в ассоциации с прогнозом смертности и смертности от инфаркта миокарда. По X-оси представлены значения параметров HDL-С и по Y-оси представлены предикторы смертности через 2 года в TRIUMPH. А также смертность от инфаркта миокарда через 5 лет в IHCS после корректировки всех кривых. Пунктирные линии показывают 95% доверительный интервал. (А) для ХС ЛПВП, (В) HDL2-С, (С) HDL3-С.
* Результаты были совместимы по модели 1, 2, и 3.
Модель 1 была без корректировок в обеих группах. Модель 2 была скорректирована по GRACE score в TRIUMPH, и по возрасту и полу в IHCS.
Выводы TRIUMPH и IHCS [5].
1.Результаты проведенного исследования, дополненные приоритетным биологическим, эпидемиологическим , клинически доказанным материалом, дают право выделить подкласс HDL3 в качестве основного маркера риска.
- Проводя вторичную профилактику, следует учитывать повышенный риск для долгосрочных жестких клинических событий, связанных с низким уровнем HDL3-C. Это не касается значений HDL2-C или HDL-C.
- Полученные результаты подчеркивают важность разделения ЛПВП на подклассы для стратификации риска.
В исследовании GISSI-HF [4] установлено значительное снижение уровня ХС ЛПНП через 3 года лечения розувастатином. Однако препарат не улучшал клинические показатели. Не было объяснено отсутствие различий в отношении первичных и вторичных конечных точек. Назначение больным ИБС фибратов и никотиновой кислоты [6] увеличивает концентрацию ЛПВП, но, парадоксально, не сокращает смертность. Применение препарата RVX-280 на фоне терапии статинами повысило ЛПВП на 10,9%, снизило ЛПНП на 16%, но не повлияло на частоту сердечно-сосудистых.осложнений. Есть сообщения, что применение ниацина увеличивает ЛПВП, но достоверно не улучшает статистику сердечно-сосудистого риска ( Sekar Kathiresan. Massachusetts General Hospital, Boston ). В исследовании FIELD назначение фенофибрата в дозе 200 мг\сутки в течение 5 лет больным сахарным диабетом 2 типа значимо снизило частоту сердечно-сосудистых событий, но незначительно повысило ХС ЛПВП на 2%. Тот же результат был получен в трайле VA-HIT после лечения гемфиброзилом. В испытании The ACCORD Study Group проверяли гипотезу, что использование фенофибрата для повышения ХС ЛПВП плазмы и снижения триглицеридов плазмы у больных диабетом 2-го типа, уже получающих терапию симвастатином, приведет к дополнительной сердечно-сосудистой пользе по сравнению с терапией одним симвастатином. Однако частоты первичного исхода не различались достоверно между группой фенофибрата и плацебо во время 4.7 лет лечения и наблюдения [8] .Среди многоэтнических индивидуумов было установлено, что HDL-P более тесно связаны с субклиническим атеросклерозом и коронарными событиями, чем HDL-C [18] .
Mathew Budoff, MD, Los Angeles в исследовании MESA среди 1500 женщин в пост-менопаузе установил прямую зависимость между уровнем ХС ЛПВП и толщиной интима-медиа сонной артерии. Установлена дисфункция среди крупных частиц ЛПВП. Американская ассоциация сердца (AHA) не рекомендует омега-3 полиненасыщенные жирные кислоты для первичной профилактики ишемической болезни сердца. Кроме того, AHA не рекомендует жирные кислоты омега-3 для пациентов с высоким риском сердечно-сосудистых заболеваний или лиц с диабетом.
У женщин с уровнем холестерина ЛПНП 70 мг / дл или ниже вероятность геморрагического инсульта может быть более чем в два раза выше, чем у женщин с уровнем холестерина ЛПНП от 100 до 130 мг / дл. Препарат дальцетрапиб у больных сахарным диабетом повысил концентрацию ХС ЛПВП на 31% по сравнению с плацебо. Ингибиторы СЕТР [7] значительно повышали уровни ЛПВП ,но существенно не влияли на кардиоваскулярные события .
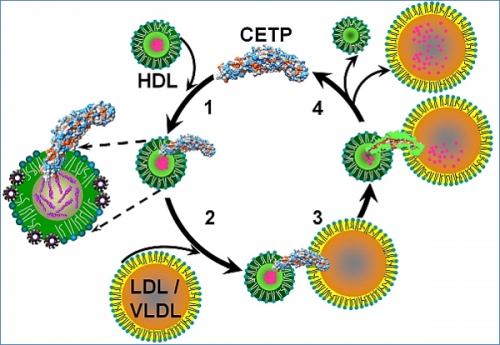
Рис. (1) CETP проникает в HDL. (2) Образование пор с обоих концов CETP. (3) Поры сопрягаются с полостью в CETP, образуя канал для трансфера холестерина, (4) что приводит к уменьшению HDL в размере. (Иллюстрация Gang Ren / Berkeley Lab.)
Рис. Эффект анацетрапиба на уровень ЛПВП.
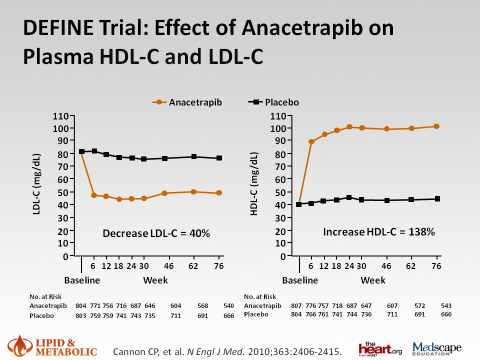
Исследования CETP-ингибиторов дают противоречивые результаты. Так в исследовании ILLUMINATE терапия торцетрапибом, несмотря на значимое повышение уровня ЛПВП на 71% и снижение уровня ЛПНП на 24%, ассоциировалась с увеличением частоты развития ССЗ на 25% и общей смертности на 58%. Другой представитель данной группы препаратов – дальсетрапиб – в исследовании dal-OUTCOMES у больных, недавно перенесших острый коронарный синдром (ОКС), приводил к увеличению концентрации ХС ЛПВП в крови, но не отличался от плацебо по частоте возникновения первичных конечных точек (смерть от ИБС, нефатальный острый инфаркт миокарда, ишемический инсульт, нестабильная стенокардия и пр.).
Результаты исследований ILLUMINATE и dal-OUTCOMES позволяют предположить, что гипотеза о целесообразности повышения уровня ХС ЛПВП для борьбы с атеросклерозом не имеет сегодня реальных подтверждений, следовательно, поиск аналогичных препаратов не имеет смысла. Таким образом, основной целью терапии, корректирующей уровень липидов в крови, по-прежнему является снижение уровня ХС ЛПНП в крови. В настоящее время статины (аторвастатин, розувастатин) превосходят все другие классы гиполипидемических средств в отношении снижения уровня данного показателя липидного профиля.
Выводы.
Разнообразие классов ЛПВП обусловлено неоднородностью физических, химических, функциональных параметров частиц ЛПВП. Биологическая активность ЛПВП детерминирована композицией белков и липидов. ЛПВП3 обладают выраженными антиатерогенными свойствами. Однако при патологических состояниях наблюдается трансформация частиц ЛПВП и утрата естественного уровня метаболизма. Уровень ХС ЛПВП, связанный с большим количеством ЛПВП2, ЛПВП3, является негативным прогностическим фактором. Дисфункция ЛПВП ведет к атерогенному повреждению сосудов. Повышение уровня ЛПВП с вазопротекторными свойствами- задача будущей терапии.
Врач-геронтолог Раповец В.А.



